
全球每年有超过2000万患者因创伤、感染、肿瘤及骨髓炎遭受骨缺损,这些损伤破坏了皮质-松质骨结构,导致血管破裂、骨髓腔暴露和机械完整性丧失。当前临床治疗需采用分阶段手术:首先以可塑性止血剂填充缺损实现快速止血,待血管稳定后移除止血材料,最后植入成骨支架促进骨再生。这种多阶段流程延长了治疗周期,增加了手术复杂性,并带来二次创伤及材料-缺损匹配不足的风险。骨蜡虽具有优异可塑性,但因其不可降解性和抑制骨再生作用,使用后必须移除;自体骨移植虽为金标准,却受限于供体可用性。现有3D打印技术复杂耗时,难以适应缺损形态的动态变化;而热敏或自修复型可注射骨材料往往内聚性差,易被血流冲散或在机械应力下碎裂。因此,开发一种能够整合精确止血、成骨促进和非侵入性监测的骨再生系统具有重要意义。
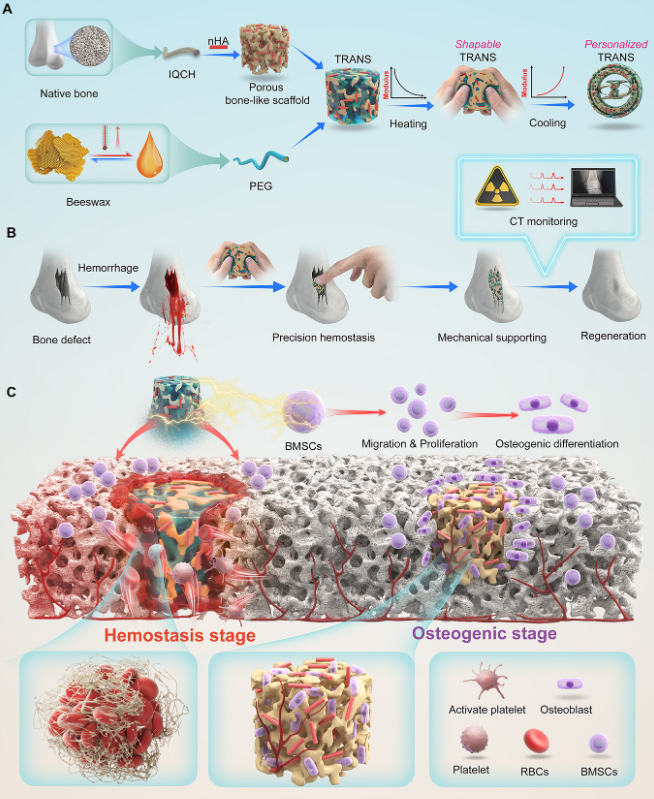
在这项研究中,湖北工业大学刘佳教授团队受天然骨结构和蜂蜡可塑性的启发,开发了一种热适应性和非侵入性可视化骨支架(TRANS)。该支架通过整合热敏且CT可视化的含碘壳聚糖衍生物(IQCH)与纳米羟基磷灰石(nHA),随后用蜂蜡样分子聚乙二醇(PEG)浸润制备而成。在生理温度下,TRANS表现出与松质骨相当的机械性能;加热时变软可塑,可精确贴合不规则缺损,降温后恢复高机械强度以确保稳定固定和有效止血。在骨再生过程中,支架内PEG被动态吸收,恢复多孔结构,从而允许干细胞浸润、增殖和成骨分化。机制研究表明,TRANS通过激活TGF-β信号通路,上调Bmp2、Id2等关键基因表达,促进骨髓间充质干细胞的迁移、增殖和分化。体内实验显示,TRANS能够有效密封大鼠骨缺损,止血时间仅为商业骨蜡的四分之一,显著减少失血。在大鼠胫骨穿孔缺损模型中,植入10周后骨体积分数达到76.3%,新骨形成与支架降解同步进行,可通过CT实时监测。
该研究提出了一种仿生策略,开发了一种集止血、成骨和实时监测功能于一体的热适应性、CT可视化骨支架(TRANS)。该支架通过模仿天然骨的结构和组成,利用热敏性含碘壳聚糖衍生物和纳米羟基磷灰石构建多孔骨样支架,并浸润PEG以获得蜂蜡样可塑性。这种仿生支架在加热时迅速软化以紧密密封不规则骨缺损,实现高效机械止血,其爆破压力达到146.3 kPa,止血时间仅为1.47分钟,约为商业骨蜡的四分之一。当温度降至生理水平时,TRANS恢复高机械强度以维持结构稳定性。值得注意的是,植入的TRANS通过在PEG移除后提供多孔网络以促进营养交换和细胞浸润,并通过激活TGF-β信号通路促进骨髓间充质干细胞增殖和成骨分化,从而增强骨再生。在胫骨穿孔缺损模型中,TRANS植入在10周内显著促进骨再生。CT监测显示了支架降解与新骨形成的同步过程,有效弥合了止血和骨修复之间的差距。这种非侵入式可视化功能将传统的骨再生"黑箱"转化为可观察的过程,为骨支架的迭代优化提供了数据驱动的概念框架。
